这些研究人员使用了基因编辑工具CRISPR-Cas9和第三代碱基编辑器(base editor 3, BE3)靶向编辑一种调节胆固醇水平的基因,从而降低了在子宫内接受过这种治疗的健康小鼠中的胆固醇水平。他们还在一小部分事先经过基因改造而携带着导致一种致命性肝脏疾病---1型遗传性酪氨酸血症(hereditary tyrosinemia type 1, HT1)---的突变的小鼠中使用产前基因编辑来改善它们的肝脏功能和阻止新生小鼠死亡。
6.Nat Med:在体内利用新型碱基编辑器有望治疗遗传疾病
doi:10.1038/s41591-018-0209-1; doi:10.1038/s41591-018-0215-3
苯丙酮尿症(phenylketonuria)的病因是编码苯丙氨酸羟化酶(phenylalanine hydroxylase, Pah)的基因发生突变。这种由肝细胞产生的酶代谢苯丙氨酸。这种代谢障碍是一种“常染色体隐性”遗传疾病:儿童如果从母亲那里遗传一个突变基因拷贝和从父亲那里遗传一个突变基因拷贝,那么就会患上这种疾病。到目前为止,这种疾病仍然是无法治愈的。
在一项新的研究中,来自瑞士苏黎世联邦理工学院和苏黎世大学的研究人员利用一种方法纠正肝细胞中的两个突变基因拷贝,从而治愈这种疾病。他们取得成功,至少是在小鼠体内。相关研究结果发表在2018年10月的Nature Medicine期刊上,论文标题为“Treatment of a metabolic liver disease by in vivo genome base editing in adult mice”。论文通信作者为苏黎世联邦理工学院的Gerald Schwank教授。
这种由胞苷脱氨酶(cytidine deaminase)加以强化的CRISPR/Cas9系统结合到这两个需要被校正的基因拷贝上,并且在局部打开DNA双链。胞苷脱氨酶将致病性的DNA碱基对C-G转化为健康人体内对应基因组位点上存在的碱基对T-A。这能够校正Pah酶编码基因中的DNA碱基错误。通过这种方法,这些研究人员改变了成年小鼠中这两个突变基因拷贝中的碱基序列。这些经过校正的肝细胞能够产生功能性的Pah酶,这些小鼠所患的这种疾病被治愈了。
7.新研究挑战用于构建条件性基因敲除小鼠的CRISPR方法
doi:10.1101/393231
在一项新的研究中,一个由全球17个实验室组成的联盟提供的结果与一项高度引用的研究(Cell, 12 September 2013, doi:10.1016/j.cell.2013.08.022)---它描述了一种利用CRISPR构建条件性基因敲除小鼠的技术---相矛盾。这项新的研究表明与那项原始的研究相比,这种技术的效率要低得多。相关研究结果[2]于2018年9月1日发表在预印本服务器bioRxiv上,论文标题为“Re-Evaluating One-step Generation of Mice Carrying Conditional Alleles by CRISPR-Cas9-Mediated Genome Editing Technology”。
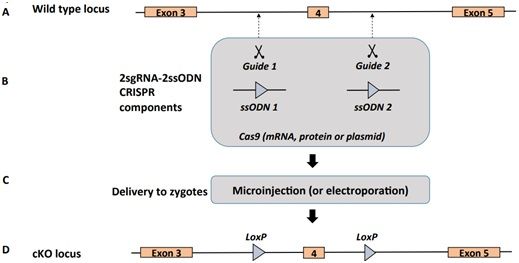
图片来自bioRxiv, doi:10.1101/393231。
这项新研究的结果指出了那项原始研究的局限性,后者取得的成功似乎被归因为剔除杂合小鼠品系中的特定基因。根据谷歌学者(Google Scholar)网站的统计,那项原始研究被引用了将近1000次。它的主要作者坚持认为他的方法是强有力的。
在学术会议和其他地方,一个紧密结合的研究团体针对其他实验室利用这种技术所面临的挑战开展的讨论使得主管澳大利亚国立大学转基因机构的Gaetan Burgio和他的同事们试图确定出了什么问题。
首先,三个实验室在不同的小鼠品系中复制了这项靶向同一个基因的原始实验,但没有取得成功。接下来,包括这三个实验室在内的17个实验室在5种不同的小鼠品系中针对小鼠基因组中的总共56个基因和2个基因间区域独立地重复这项实验。来自所有这些实验室的数据集经合并后包括17887个显微注射或电穿孔的小鼠受精卵和产生的1718只活小鼠,其中仅15只小鼠具有条件性对照所需的两个插入的LoxP位点。在所有接受测试的小鼠中,观察到脱靶的缺失或突变代替LoxP位点的正确插入。
与那项原始研究在小鼠中获得条件性敲除等位基因的效率为16%相比,Burgio和其他人的成功率仅为0.87%。
8.Nature:利用CRISPR/Cas系统开发出一种存储转录事件的细胞记录设备
doi:10.1038/s41586-018-0569-1
在一项新的研究中,来自瑞士苏黎世联邦理工学院和巴塞尔大学的研究人员利用CRISPR-Cas系统开发出一种新的记录设备:它产生的DNA片段能够提供关于某些细胞过程的信息。在未来,这种细胞存储设备甚至可能用于诊断中。相关研究结果于2018年10月3日在线发表在Nature期刊上,论文标题为“Transcriptional recording by CRISPR spacer acquisition from RNA”。
这些研究人员利用肠道细菌大肠杆菌开展研究,将来自一种不同的细菌物种的编码CRISPR-Cas系统的基因导入到大肠杆菌中。其中的一个Cas基因与一种逆转录酶融合在一起,其中逆转录酶是利用mRNA分子产生编码相同信息的DNA ---换句话说,它将mRNA逆转录为DNA。
导入这些编码CRISPR-Cas的外源基因的大肠杆菌细胞能够产生一种结合短mRNA分子的蛋白复合物。这种逆转录酶将mRNA翻译为含有与初始的mRNA相同的遗传信息的DNA,然后将它们作为间隔序列存储在CRISPR阵列中。这种过程能够多次发生,从而使得新的间隔序列以相反的时间顺序添加到CRISPR阵列,因此最近获得的DNA片段总是位于最前面。
作为他们研究的一部分,这些研究人员记录了配备有这种数据记录器的大肠杆菌对除草剂百草枯作出的反应。这种除草剂引起细胞内mRNA转录发生变化,这样他们就能够在接触除草剂几天后从CRISPR阵列中读出这种反应。如果没有这种数据记录器,大肠杆菌与这种除草剂接触的任何分子痕迹早就会被破坏,这种信息也就丢失了。
9.Nat Biotechnol:利用CRISPR-Cas9基因组编辑技术从头培育出新的作物品种
doi:10.1038/nbt.4272
在一项新的研究中,来自巴西、美国和德国的研究人员首次使用CRISPR-Cas9(一种现代的基因组编辑过程)在一代中就利用野生植物中培育出新的作物。从野生番茄开始,他们引入了多种作物的性状,同时又不会丧失这种野生植物的宝贵遗传特性。相关研究结果于2018年10月1日在线发表在Nature Biotechnology期刊上,论文标题为“De novo domestication of wild tomato using genome editing”。

图片来自Nature Biotechnology, doi:10.1038/nbt.4272。

